Auch Schweizer Patienten sind Versuchsobjekte
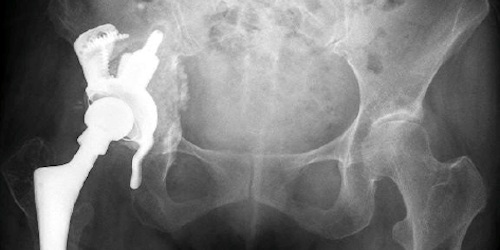
Opfer gibt es viele: Zehntausende von fehlerhaften Hüftgelenken mussten sich Patienten vor drei Jahren ersetzen lassen, und vor zwei Jahren erfuhren weitere Zehntausende von Frauen, dass sie fehlerhafte Brustimplantate im Körper hatten und liessen sie ersetzen.
Wer in der Schweiz ein Brustimplantat, eine Hüftprothese oder einen Herzschrittmacher erhält, muss viel Vertrauen haben. Vertrauen darauf, dass die Implantate tatsächlich nützen, einwandfrei funktionieren und sicher sind. Denn bei Medizinprodukten wird nur geprüft, ob sie nach EU-Norm technisch einwandfrei produziert sind. Ob sie sich am Patienten bewähren, zeigt sich erst, wenn Chirurgen sie eingesetzt haben. Es kommt viel zu häufig vor, dass künstliche Gelenke, Stents oder Herzkatheter nach Warnungen oder gar Todesfällen wieder aus dem Verkehr gezogen werden.
Keine Zulassung nötig
Anders als bei Medikamenten braucht es für Implantate, Herzkatheter oder künstliche Gelenke auch in der Schweiz keine Zulassung, sondern nur ein CE-Siegel. Für die Vergabe des CE-Siegels sind rund 80 von der EU anerkannte Prüfstellen (sogenannte Notified Bodies) zuständig wie der deutsche TÜV, aber auch private. Einige dieser CE-Prüfstellen sind auch in der Schweiz ansässig. «Geprüft» werden allerdings vor allem Dokumente der Hersteller. Und: Die Hersteller können eine willfährige Prüfstelle nach ihrer Wahl beauftragen. Das Geschäft der Prüfstellen hängt von den Aufträgen der Implantat-Hersteller ab. Ein klassischer Interessenkonflikt.
Zertifizierung eines fiktiven Hüftgelenks
Wie einfach es ist, für ein Hüftgelenk ein CE-Zertifikat zu erhalten, haben letztes Jahr Reporter des «British Medical Journal» und des «Daily Telegraph» bewiesen: Es ist ihnen ohne weiteres gelungen, die europäische Marktzulassung für ein Hüftgelenk zu erhalten, das gar nicht existiert. Aus den fiktiven Unterlagen, welche die Reporter bei 14 Zertifizierungsstellen eingereicht hatten, ging hervor, dass das Hüftgelenk giftige Stoffe absondert und aufgrund von Konstruktionsmängeln wohl bald brechen würde. Das Design der Prothese war eine Beschreibung einer früheren fehlerhaften Prothese. Die Reporter gaben sich als Vertreter der ebenfalls fiktiven Firma «Change Medical» aus. All dies hinderte EU-Zertifizierungsstellen nicht daran, das CE-Gütesiegel zu verleihen. (Link zum Artikel im «British Medical Journal»)
USA nützen Europa als Testlabor aus
Die lasche europäische Praxis nützen amerikanische Hersteller aus. Weil in den USA die Hürde für eine Marktzulassung höher ist, und weil die Haftpflichtgesetze viel strenger sind, bringen die Hersteller neue Medizinprodukte zuerst in europäischen Ländern auf den Markt. Europa, auch die Schweiz, dient den USA als Testlabor. Die Patienten Europas sind die Versuchskaninchen.
«Schlechter geprüft als Haushaltgeräte»
Wie gravierend die Mängel dieses Zulassungssystems sind, hat kürzlich auch ein Beitrag des ARD-Wirtschaftsmagazins «Plusminus» gezeigt. Demnach sind nicht nur die gesetzlichen Vorgaben der Behörden unzureichend, sondern auch das System der europäischen Prüfstellen steht in der Kritik. Auch «Plusminus» kritisiert, dass Hersteller die Prüfstelle europaweit selber aussuchen können. Das bedeutet: Allzu streng dürfen die Institute nicht sein. Wer als streng gilt, muss mit weniger Aufträgen rechnen. Einzelne Prüfstellen werben sogar ganz offen damit, «mit reduziertem Testumfang eine Zulassung sicherzustellen».
So kommt es, dass Herzschrittmacher und künstliche Gelenke mit einem einfachen CE-Kennzeichen gemäss «Plusminus» teilweise schlechter geprüft werden als Haushaltsgeräte und trotzdem europaweit in Spitälern zum Einsatz kommen. Stellt sich bei Patienten nachträglich heraus, dass Material oder Verarbeitung mangelhaft ist oder dass unerwünschte Nebenwirkungen auftreten, sprechen Hersteller von «bedauerlichen Einzelfällen». Wie viele Betroffene es tatsächlich gibt, darüber schweigt die Branche – aus Rücksicht aufs Geschäft. Auch die Behörden haben keinen Überblick.
Ärzte und Hersteller haben wenig zu befürchten
Nach dem Skandal um schadhafte Brustimplantate hatten EU-Politiker strengere Regeln für die Zulassung von Medizinprodukten angekündigt. Neue Auflagen sind in Vorbereitung – aber laut «Plusminus» sind sie unzureichend und würden frühestens 2015 in Kraft treten. Sie sehen eine bessere Überwachung der europäischem Prüfstellen vor. Werden dabei Mängel entdeckt, soll den Zertifizierungsstellen der Auftrag entzogen werden. Die Prüfer sollen bei ihren Auftraggebern Kontrollen vor Ort machen müssen, ohne sich vorher anzumelden wie bisher üblich. Und auch nach der Markteinführung sollen Medizinprodukte regelmässig kontrolliert werden.
Zudem ist ein zentrales Produkte-Register vorgesehen, damit sich jederzeit zurückverfolgen lässt, welche Implantate die Patienten erhalten haben. Ein solches Register existiert in der Schweiz seit 2012, allerdings nur für Knie- und Hüftprothesen. Um Schäden rechtzeitig zu erkennen, sammelt das Schweizerische Heilmittelinstitut Swissmedic Meldungen von Ärzten und von Herstellern über «schwerwiegende Vorkommnisse und Gefährdungen» bei Implantaten. Diese Meldungen macht Swissmedic jedoch nicht öffentlich zugänglich, und bei nicht erfolgten Meldungen haben Ärzte und Hersteller wenig zu befürchten.
Gesundheitsexperten fordern strengere Kontrollen
In einer Analyse im britischen Fachmagazin «British Medical Journal» warnen Experten des Spitzenverbands der deutschen Krankenkassen, die Pläne der EU Kommission würden nicht ausreichen, um Patienten besser zu schützen. Nach wie vor könnten Medizinprodukte ohne Genehmigung einer Behörde auf den Markt gebracht werden. Alles erfolge nur «in Verantwortung des Herstellers». Zudem fordern Gesundheitsexperten dass nicht nur die Qualität, sondern auch der Nutzen von neuen Medizinprodukten bewertet wird.
Nach aufgeflogenen Mängeln und Rückrufen von Medizinprodukten versprachen EU-Politiker strengere Regeln zum Schutz der Patienten. Doch Gesundheitsexperten befürchten, dass mit den vorgeschlagenen Massnahmen ein schwacher Kompromiss droht, der weiterhin vor allem den Herstellern entgegenkommt.
Themenbezogene Interessenbindung der Autorin/des Autors
Keine









Ebenso fragwürdig wie die Qualität von künstlichen Gelenken können ärztliche Diagnosen sowie Empfehlungen aus dem Freundeskreis sein, welche zu solchen «einfachen» Operationen raten. Mit etwas weniger Geduld wäre ich, nach längeren starken Hüftschmerzen, – heute beschwerdefrei – Träger eines künstlichen Hüftgelenkes.
Wann kommen Patienten endlich auf die Idee, sich genau wie bei jeder anderen grösseren Anschaffung nach Marke, Jahrgang, ev. Referenzen zu erkundigen vor solch einer OP? Dann wäre die Sache bald geregelt! Einige suchen sich ja immerhin schon den Chirurg selbst aus, dem darf man dann hoffentlich auch trauen. Wir sind nämlich gar nicht so abhängig und ohnmächtig, wie wir glauben.
@Ilse Czamek:
Auch als sehr kritischer Konsument hätte ich es mir niemals träumen lassen, dass die Zulassung für diese Produkte so fahrlässig unzuverlässig erfolgt!